Nat Neurosci :闫超/丛启飞/刘翔宇/李新建合作揭示小胶质细胞介导的抑制性突触清除在癫痫中的作用
来源:brainnews 2025-06-02 16:38
该研究系统揭示了癫痫病理状态下,小胶质细胞通过选择性“修剪”抑制性突触,引起兴奋/抑制失衡,进而促进癫痫疾病进展的分子机制。
神经超兴奋性(neuronal hyperexcitability)是多种神经系统疾病的共同特征,其中以癫痫最为典型。兴奋性与抑制性突触传递失衡(E/I imbalance)是导致神经超兴奋性的重要原因之一,但是诱导兴奋/抑制失衡的细胞和分子机制尚不完全明确。

作者首先通过在海人酸KA诱导的小鼠癫痫模型中通过光纤记录实验发现,癫痫发作时抑制性神经元大量释放GABA,这种抑制性神经递质竟然激活了小胶质细胞!通过在CX3CR1-GCaMP6s小鼠(小胶质细胞内特异性表达钙指示荧光蛋白)上进行在体双光子成像实验,作者发现GABAB受体阻断剂可显著抑制KA诱导的小胶质细胞钙活动,提示GABA递质可能作为“find-me”信号,诱导小胶质细胞的激活,并招募小胶质细胞靠近抑制性突触。
在大脑发育过程中,小胶质细胞的突触修剪功能对于维持神经系统的正常发育至关重要。那么,癫痫病理状态下,小胶质细胞是否也影响了突触稳态呢?在KA诱导的癫痫小鼠模型中,作者发现海马锥体层的抑制性突触随疾病进程发生了持续性丢失,而兴奋性突触未受明显影响。进一步,作者通过三维重构分析发现,小胶质细胞的溶酶体中存在大量抑制性突触VGAT信号,提示小胶质细胞吞噬了大量抑制性突触。更重要的是,抑制小胶质细胞激活或清除小胶质细胞均能有效阻止抑制性突触丢失,缓解癫痫症状。
突触修剪通常由“find-me”和“eat-me”信号协同完成。作者进一步发现:GABA通过GABAB受体介导的“find-me”信号,激活小胶质细胞;而补体分子C3则作为“eat-me”信号标记抑制性突触,诱导小胶质细胞对其进行选择性吞噬。特异性敲除小胶质细胞的GABAB受体,或星形胶质细胞的补体C3,均能显著降低小胶质细胞对抑制性突触的吞噬并改善模型小鼠的癫痫症状。
研究团队还对癫痫患者的脑组织进行了单细胞核测序,发现同样存在一群对GABA信号高度响应且吞噬能力显著上调的小胶质细胞亚群,并观察到其与抑制性神经元的互作增强。实验证据显示,患者样本中小胶质细胞大量吞噬抑制性突触,进一步验证这一机制在人类中同样存在。
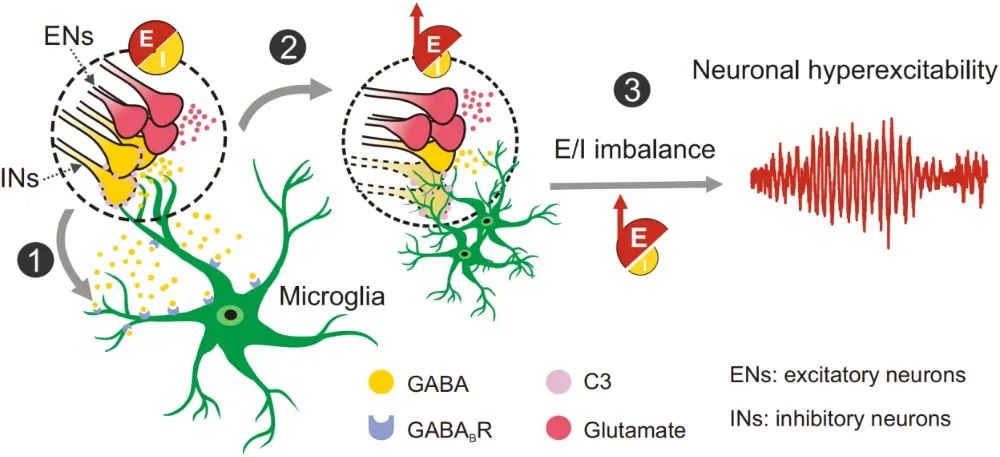
图1. 文章假说机制图
原文链接:
https://doi.org/10.1038/s41593-025-01979-2
Chen ZP, Zhao X, Wang S, Cai R, Liu Q, Ye H, Wang MJ, Peng SY, Xue WX, Zhang YX, Li W, Tang H, Huang T, Zhang Q, Li L, Gao L, Zhou H, Hang C, Zhu JN, Li X, Liu X, Cong Q, Yan C. GABA-dependent microglial elimination of inhibitory synapses underlies neuronal hyperexcitability in epilepsy. Nat Neurosci. 2025 May 27. doi: 10.1038/s41593-025-01979-2. Epub ahead of print. PMID: 40425792.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


